Tratamiento de tumores de ovario en progresión con la combinación terapéutica del AcM Nimotuzumab y la vacuna NGGM3/VSSP
Treatment of progressive ovarian tumors with the therapeutic combination of the AcM Nimotuzumab and the NGGM3/VSSP vaccine
Raiza Ruiz 1, Daisy Hernández1, Carmen Viada2, Jessica García1, Martha Fors3*,Mayra Ramos. 2
1 Hospital Ramón González Coro. La Habana, Cuba; raiza2661@gmail.com;
1 Hospital Ramón González Coro. La Habana, Cuba; daysi@infomed.sld.cu;
2 Centro de Inmunología Molecular. La Habana, Cuba; carmen@cim.sld.cu;
1 Hospital Ramón González Coro. La Habana, Cuba; jessica@infomed.sld.cu;
3 Universidad de Las Américas, Quito, Ecuador;
2 Centro de Inmunología Molecular. La Habana, Cuba; mayra@cim.sld.cu;
3 Universidad de Las Américas, Quito, Ecuador;
2 Centro de Inmunología Molecular. La Habana, Cuba; mayra@cim.sld.cu;
*Correspondence: forsmarthamaria@gmail.com
RESUMEN
El cáncer de ovario ocupa el tercer lugar entre los cánceres ginecológicos y representa el 4% de los cánceres en la mujer. Las inmunoterapias antitumorales constituyen nuevas herramientas terapéuticas para la identificación de moléculas que se expresen diferencialmente en las células tumorales. Se realizó un estudio exploratorio para evaluar la seguridad y eficacia de un preparado vacunal que contiene NGlicolilGM3 (NGGM3/VSSP) y el Anticuerpo Monoclonal Nimotuzumab (AcM CIMAher). Ambos productos han demostrado ser seguros y se pueden aplicar en combinación con la quimioterapia (QTP). La supervivencia (SV) del grupo de pacientes a las que se les aplicó QTP, AcM Nimotuzumab y la vacuna NGGM3/VSSP fue superior al grupo que no recibió quimioterapia. El efecto antitumoral de la combinación puede ser sinérgico, ya que las terapias van dirigidas a dos blancos tumorales y actúan a través de mecanismos diferentes.
Palabras claves: cáncer de ovario, quimioterapia, inmunoterapia, AcM Nimotuzumab, vacuna NGGM3/VSSP
ABSTRACT
Ovarian cancer ranks third among gynecological cancers and accounts for 4% of cancers in women. Antitumor immunotherapies constitute new therapeutic tools for identifying molecules differentially expressed in tumor cells. An exploratory study evaluated the safety and efficacy of a vaccine preparation containing NGlicolilGM3 (NGGM3/VSSP) and the Monoclonal Antibody Nimotuzumab (AcM CIMAher). Both products have proven to be safe and can be applied in combination with chemotherapy (QTP). Survival (OS) in patients who received QTP, AcM Nimotuzumab, and the NGGM3/VSSP vaccine was superior to those who did not receive chemotherapy. The antitumor effect of the combination may be synergistic since the therapies are directed at two tumor targets and act through different mechanisms.
Keywords: ovarian cancer, chemotherapy, immunotherapy, AcM Nimotuzumab, NGGM3/VSSP vaccine
INTRODUCCIÓN
El cáncer de ovario ocupa el tercer lugar entre los cánceres ginecológicos, representa el 4 % de los cánceres de la mujer y a él corresponde la mayor mortalidad entre ellos (5 % de todas las muertes ocasionadas por cáncer)1. Se presenta en todas las edades, incluidas la niñez y la adolescencia. 300.000 de casos por año a nivel mundial1. En Cuba, en el 2018, se reportaron 383 casos para una tasa cruda de 8,2 × 105, que aumenta hasta 19,4 en las mayores de 60 años. En el 2016, 219 mujeres murieron por cáncer de ovario3,4. El 70% de las mujeres recaen dentro de los 3 años siguientes al tratamiento de primera línea2.
En los países con alta incidencia de cáncer de ovario la supervivencia global (SV) es inferior al 50 % a los 5 años. La mediana de SV a los 5 años (SV5 años), incluyendo todos los estadios, es de aproximadamente 46, 5 % para los tumores epiteliales.5.6 El pronóstico del cáncer de ovario está íntimamente relacionado con la etapa clínica en el momento del diagnóstico. La estadificación es quirúrgica y se realiza utilizando el sistema de la Federación Internacional de Ginecología y Obstetricia (FIGO).7
El tratamiento inicial del cáncer de ovario es quirúrgico. La cito reducción óptima puede lograrse en el 90 % de las pacientes y constituye una variable pronostica independiente para la supervivencia.8La persistencia y las recidivas son muy frecuentes en los cánceres epiteliales del ovario; ocurren en la mayoría de las enfermas, y se encuentra una persistencia en el 75"-85 % de las mujeres tratadas (H" 20 % sin respuesta alguna) y recurrencia hasta en el 50 % después de una re laparotomía negativa.9 La quimioterapia es el arma fundamental para tratar la enfermedad persistente o recurrente.10
Las inmunoterapias antitumorales constituyen nuevas herramientas terapéuticas donde la estrategia fundamental ha sido la identificación de moléculas que se expresen diferencialmente en las células tumorales.11 Para esta localización tumoral, en la actualidad los anticuerpos monoclonales (AcM) anti VEGF (Bevacizumab) y los inhibidores del PARP se añaden a la terapéutica de control de la enfermedad avanzada.12-
13-14
Los AcM con fines terapéuticos inducen la muerte de la célula tumoral mediante diversos mecanismos: citotoxicidad celular dependiente de anticuerpo, citotoxicidad dependiente del complemento y apoptosis entre otros.15 Los gangliósidos forman parte del grupo de moléculas que cambian sus patrones de expresión durante la transformación oncogénica de las células.16 En las últimas décadas, existen evidencias de la relación estructural y funcional del EGFr con diferentes gangliósidos sobre la membrana celular.17
Los gangliósidos son glicoesfingolípidos que se encuentran presentes en la membrana plasmática de todas las células de mamíferos, caracterizados por contener ácido siálico y se encuentran sobre-expresados en los tejidos de origen neuroectodérmico y particularmente tumores como el melanoma, los astrocitomas, sarcomas, neuroblastomas y el cáncer de pulmón de células pequeñas, otras evidencias han mostrado su expresión en ovario, mama y riñón.17 Dentro de sus funciones inmunológicas está actuar como receptores para ligandos en las células de adhesión, como agentes inmunorreguladores de la respuesta proliferativa de los linfocitos a antígenos y mitógenos y como reguladores del crecimiento celular.16-17
El Centro de Inmunología Molecular (CIM) cuenta con un preparado vacunal que contiene al gangliósido NGlicolilGM3 (GLICOVAX) adosado al VSSP de las ingles very small size proteolyposoma (nanopartícula preparada a partir de la membrana externa de la Neisseria Meningitides), además con el Anticuerpo Monoclonal humanizado (AcM) Nimotuzumab anti-receptor del factor de crecimiento epidérmico. El efecto de la combinación de ambos tratamientos dirigido a dos dianas tumor asociado diferentes puede ser sinérgico.18
MATERIALES Y MÉTODOS
Se realizó un ensayo exploratorio para evaluar la seguridad e inmunogenicidad de la combinación de la vacuna GLICOVAX y el AcM Nimotuzumab en 45 pacientes con cáncer de ovario avanzado, donde se determinaron por estudios de inmunohistoquímica (IHQ) doble marcaje positivo al EGFr y al gangliósido NGGM3 durante los años 2009 al 2011.
El objetivo principal fue evaluar la seguridad de la combinación de ambos productos (además solos o con quimioterapia) y la supervivencia global de las pacientes con cáncer de ovario, en progresión, tratadas con la combinación terapéutica. Los criterios de inclusión incluyeron la confirmación cito histológica de cáncer de ovario, en progresión de la enfermedad después de los tratamientos oncoespecíficos, con edad igual o mayor de 18 años, ECOG ≤ 3, expectativas de vida mayor de 3 meses, acceso al bloque del tumor primario de la paciente a incluir en el estudio para la clasificación de los receptores EGFr y el Gangliosido NGGM3 por técnicas de IHQ y que dieran su consentimiento firmado para participar en el estudio. Se excluyeron aquellas pacientes que estuvieran recibiendo otro producto en investigación, embarazadas o en periodo de lactancia, historia de enfermedades autoinmunes o que habían sido tratados recientemente con inmunosupresores y con enfermedades crónicas no controladas.
El esquema de tratamiento de los productos de investigación se dividió en dos partes, el Nimotuzumab en la etapa de inducción se administró dosis de 200 mg: 1 vez a la semana por 12 semanas y etapa mantenimiento: 200 mg, 1 vez cada 21 días y la Vacuna NGGM3: en la etapa de inducción se administró 5 dosis cada 14 días (0, 14, 28, 42, 56 y 84) y la etapa de mantenimiento re-inmunizaciones cada 28 días a partir del tercer mes, hasta completar un año de tratamiento para ambos tratamientos o hasta la aparición de toxicidad no manejable o el empeoramiento del estado general del paciente por encima de 3 según la escala ECOG.
Para la evaluación de seguridad se realizó el análisis de la toxicidad y se tuvo en cuenta todos los eventos adversos (EA) presentes en los pacientes luego de la inclusión en el estudio según criterios comunes de toxicidad (CTCAE, versión 4.0), estudio independientemente del número de dosis recibidas. En la evaluación de eficacia la variable principal analizada fue el tiempo de supervivencia (SV) medido desde la fecha de inicio del tratamiento hasta la fecha del fallecimiento, se incluyó la respuesta antitumoral con la evaluación de la respuesta o progresión utilizando los criterios internacionales propuestos por el Comité de Criterios de Evaluación de Respuesta en Tumores Sólidos (RECIST) (JNCI 2000; 92: 205-216) después del tercer y sexto ciclos de la primera línea de quimioterapia; después del tercer y sexto ciclos de la segunda línea de quimioterapia, y luego cada 3 meses hasta el segundo año de seguimiento de cada paciente.
Para el análisis estadístico se estimaron los tiempos de supervivencia de todos los pacientes a partir del inicio del tratamiento, varianzas y los intervalos de confianza para estos, mediante el estimador no paramétrico de Kaplan-Meier. Se compararon las curvas de la supervivencia mediante la prueba de Log-Rank, nivel de significación a= 0.05 y una prueba bilateral. Se aplicó el modelo de regresión de Cox para evaluar la influencia de las variables pronósticos considerados en el tiempo de supervivencia. Se incluyó la correlación que se establece entre la expresión de los receptores y la supervivencia.
RESULTADOS
En el análisis de los resultados demográficos y las características de la enfermedad se realizó por separado en cada sub-set de pacientes clasificados en Platinos sensibles y Platinos resistentes de acuerdo con el comportamiento de la respuesta terapéutica de cada uno de los grupos. Las pacientes caucásicas predominaron en ambos grupos con el 75 y 59,4 % de las Platinos resistentes y sensibles respectivamente; similar comportamiento tuvo el ECOG donde fue similar el predominio del ECOG 0 en ambos grupos con el 75 y 51,1 % independientemente de que se incluyeron pacientes en etapas avanzadas de la enfermedad y con recaídas o persistencias de las líneas de quimioterapias (QTP) establecidas para esta patología y etapa clínica, en esta variable predominó en ambos grupos la etapa III con 75% para las platino resistentes y 56,7% para las platinos sensibles, el 10% de las pacientes del grupo Platinos resistente presento un tumor epitelial (seroso), mientras que en las Platinos sensibles el 53, 1 % fueron de esta misma de estirpe histológica. (Tabla 1)
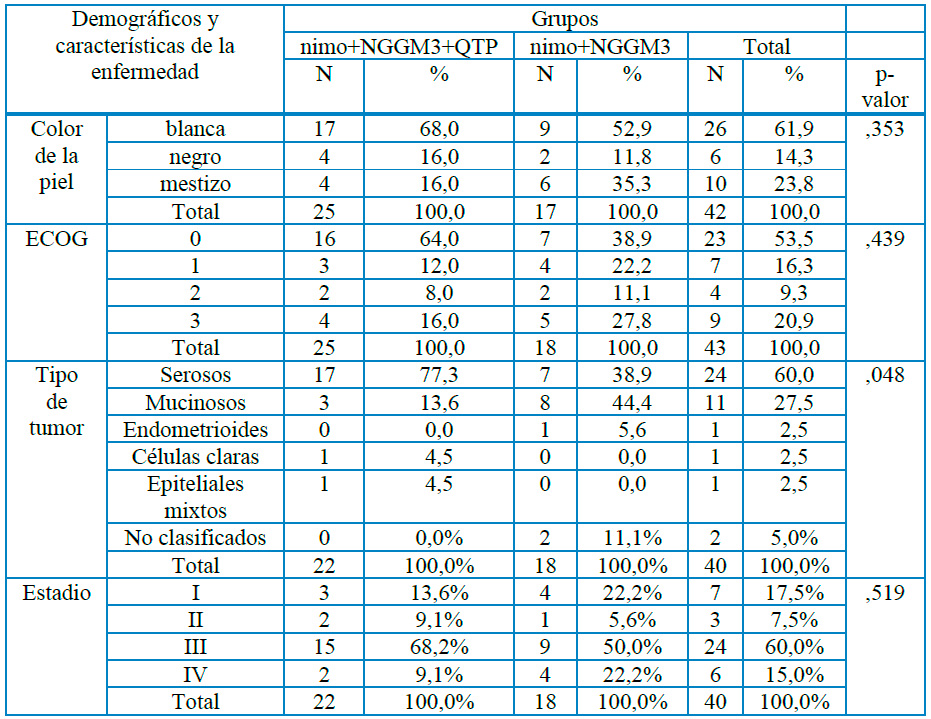
Tabla 1. Demográficos y características de la enfermedad
La mayoría de los autores coinciden en que la incidencia de los tumores de acuerdo con su estirpe histológica varía según la edad y la mayor prevalencia se encuentra entre la sexta y séptima décadas de la vida. La edad mediana al diagnóstico es de 63 años.6 Más del 80 % (≈ 90%) son cánceres epiteliales y son más frecuentes entre las caucásicas; el resto deriva de las células germinales y del estroma de los cordones sexuales.7. La incidencia es mayor en nulíparas y en mujeres con historia familiar de cáncer de ovario (mutaciones del BCRA1 Y BCRA 2).4 Su incidencia ha aumentado en las últimas décadas, pero la evolución insidiosa o silente que lo caracteriza entorpece el diagnóstico temprano, lo que hace que más del 60 % de las enfermas se diagnostiquen en etapa avanzadas.7
El tratamiento del cáncer de ovario es fundamentalmente quirúrgico por la necesidad de realizar el diagnostico histológico y estadiamiento de la enfermedad, así los tumores localizados al órgano que le dio origen o se encuentren limitados al abdomen se le realiza tratamiento quirúrgico y la radicalidad del mismo estará en relación directa a la supervivencia posterior de la paciente.8 En este estudio se cumple con esta premisa y tanto el 84% de la pacientes del grupo que recibe el Nimotuzumab-Glicovax-Quimioterapia como el 77,8% de los casos con inmunoterapia solamente de Nimotuzumab-Glicovax se realizó tratamiento de cirugía previa a la terapia sistémica. (Tabla2)

Tabla 2. Tratamientos previos recibidos
La quimioterapia no está indicada en la etapa I, su administración en etapas más avanzadas de la enfermedad es imprescindible para su control. Shih y colaboradores reportan apropiadamente 3 años de intervalo libre de progresión (PFS) en pacientes con etapas avanzadas con y sin tratamiento de quimioterapia de 70,6% vs 89,9% respectivamente.19Estos indicadores demuestran que la quimioterapia no altera la recurrencia de la enfermedad. Los factores de riesgo elevados para que esta ocurra incluyen el estadio avanzado, estadiamiento incompleto, enfermedad residual después de la cirugía primaria y la preservación del ovario.20
Los tratamientos a bases de platinos han sido la base fundamental de la quimioterapia durante décadas para el cáncer de ovario. Actualmente el Carboplatino en adición con el Paclitaxel es el tratamiento de primera línea en las etapas avanzadas. Entre un 20 a 40% de las pacientes no responden al tratamiento primario, sin embargo, el 80% exhibe una respuesta inicial positiva, especialmente los subtipos clasificados como serosos de alto grado. La resistencia al tratamiento con platino ocurre con el tiempo.21-22 Basado en el más reciente consenso de la conferencia sobre cáncer de ovario de la Sociedad Europea de Ginecología Oncológica (ESGO) y la Sociedad Europea de Oncología Médica (ESMO), publicado en mayo de 2019 y hasta el presente, no se han validado marcadores moleculares predictivos de resistencia al platino.23
En el tratamiento actual recomendado como primera línea, a los pacientes se les suele administrar de seis a ocho ciclos cada 21 días. Las contraindicaciones para una combinación de Paclitaxel y Carboplatino son un mal estado funcional general (PS≤ 3 según la OMS), comorbilidades significativas (insuficiencia cardíaca, cardiopatía isquémica, neuropatía, etc.).24 La Doxorubicina liposomal (PLD) se puede utilizar como alternativa al Paclitaxel, pero ha demostrado una mayor incidencia de toxicidad hematológica y dermatológica y estomatitis. Sin embargo, provoca menos neurotoxicidad y alopecia.25 En pacientes con mal estado funcional, comorbilidades y edad avanzada, es de esperar que tengan dificultades para soportar el tratamiento sistémico combinado en dosis completas de tres semanas y es menos probable que completen el curso de la terapia.26-27 En pacientes con enfermedad avanzada (estadios IIIB, IIIC y IV), hay dos tipos de agentes diana disponibles para la terapia de mantenimiento: Bevacizumab e inhibidor de PARP.12-13-14 En nuestro país es muy limitado el uso de algunos citostáticos como la Doxorubicina liposomal (PLD), el AcM Bevacizumab y los inhibidores del PARP por lo que, la utilización de los productos biotecnológicos, en este caso la vacuna NGgM3/VSSP se convierte en una oportuna alternativa terapéutica este escenario de pacientes en etapas avanzadas o con comorbilidades que impiden la aplicación de la quimioterapia sistémica en dosis adecuada.
En el análisis de la seguridad se reportaron como principales eventos adversos relacionados (EAR) con comportamiento similar en ambos grupos de tratamientos el dolor en el sitio de la inyección con el 16,7% para los que recibieron la tri terapia y un 14, 3% para el grupo que solo recibió los productos de investigación, al igual que los escalofríos con un 20,8 y 28,6 % respectivamente. Otros EAR tuvieron reportes muy diferentes, predominando en el que se añade la QTP a la inmunoterapia la diarreas, dolores articulares, dolores óseos (4,2%), fiebre (29,2%), temblores (8,3%) y los vómitos (4,2%) los cuales no se presentaron o fueron en porcientos muy ínfimos en el grupo que solo se le administró la inmunoterapia a excepción de los temblores con un reporte de 14,3% y los escalofríos con un 28,6% en el grupo que recibe el AcM Nimotuzumab y la vacuna NGGM3/VSSP, sin significación estadística.(Tabla 3)

Tabla 3. Pacientes que reportaron EA en el Programa de Uso Clínico Expandido
El AcM Nimotuzumab tiene un amplio uso en combinación con otras terapias oncoespecíficas en tumores de origen epitelial. En un estudio retrospectivo publicado en 2016, donde se evalúan los resultados de la aplicación de este en 250 pacientes con diagnósticos histológicos de cáncer avanzado en cabeza y cuello, colón, gástrico, células no pequeñas de pulmón y esófago se demuestra que el tratamiento con este AcM en combinación con QTP es bien tolerado y no se atribuye EAG en este grupo de pacientes. Se reportan un total de 381 EA. En general los EA son trastornos gastrointestinales (43,0 %), alteraciones de las enzimas hepáticas transaminasas pirúvica y oxalacética (38,3 %) y trastornos del metabolismo y nutrición (31,5 %). Las alteraciones de la piel y del tejido subcutáneo solo representan el 3,7 % de los EA, clasificando un 22 % de EA como grado tres o cuatro.15
La adición de Nimotuzumab a diferentes regímenes quimioterapéuticos para distintos tipos de tumores no aumenta la toxicidad de esta. Se informa EA para otros AcM anti-EGFr que ya están en el mercado, como el Cetuximab y el Panitumumab con mayor frecuencia e intensidad, que incluso hacen necesario detener la administración del producto o hacerlo con pre medicación.27 Bebb y colaboradores en un análisis de la toxicidad cutánea de los AcM anti EGFr que se utilizan en diferentes localizaciones de cáncer, encuentran una baja tasa de reportes de toxicidad grado tres para Nimotuzumab al combinarlo con quimioterapia y ninguna toxicidad en relación con Nimotuzumab en monoterapia, no sólo en la etapa de inducción sino también en el mantenimiento del tratamiento aun después de la progresión tumoral.28
DISCUSIÓN
En el análisis de la supervivencia (SV) por intención de tratamiento, que incluye todos los casos independientemente de las dosis recibidas, se obtuvo una mediana de 17, 9 meses para el grupo de pacientes a las que se les administró el Nimotuzumab-Glicovax-Quimioterapia y de 6,4 meses para la combinación de la inmunoterapia sin QTP asociada. En un estudio, Gershenson y colaboradores demostraron una supervivencia libre de progresión (SLP) de 28.1 meses en un estudio que incluyó 350 pacientes, de las cuales el 83.4% tenían al diagnóstico una etapa III de la enfermedad según la clasificación de la FIGO. El autor concluye que los peores pronósticos para la sobrevida global (SV) fueron la edad mayor de 35 años y la enfermedad persistente después de concluir el tratamiento primario.29
La quimio-resistencia ocurre entre el 20 al 30% de los pacientes durante el tratamiento primario. La mayoría de los pacientes responden bien al tratamiento, pero el 80 % de los pacientes tienen una supervivencia libre de progresión de 18 meses como promedio, cuando hay recaída antes de los 12 meses de concluido el tratamiento solo el 50 % tiene posibilidades de respuesta terapéutica y en un 10-20% la recaída puede ser antes de los 6 meses del inicio del tratamiento. Cada vez que ocurre una nueva recurrencia, el intervalo para la próxima es cada vez más corto y una mayor probabilidad de resistencia a la enfermedad.21.22
En este estudio no se llevó a cabo la diferenciación de las pacientes por la sensibilización a las terapias de platino ya que en el momento que se desarrolló el mismo la disponibilidad de las quimioterapias era muy variable, sin embargo, todas las pacientes estaban en una etapa de progresión de la enfermedad muy avanzada y habían recibido diferentes esquemas terapéuticos de acuerdo con la disponibilidad de cada institución.
Las pacientes a las que se le agregó la quimioterapia en la combinación con la inmunoterapia, las tasas de supervivencia a los dos años fueron superiores a lo esperado, siendo del 25,7 % para la tri-terapia y solo del 10 % para la terapia inmunológica sola. Es de señalar además que estas tasas y supervivencias globales no son las esperadas para estos grupos de pacientes (Figura 1)

Figura 1. Datos de supervivencia de las pacientes incluidas en el estudio clinico por intencion de tratamiento (todas las pacientes).
Como concluyeron Lee y Matulonis, muchos mecanismos, ya descritos, requieren validación clínica. Además, los múltiples mecanismos de resistencia descritos también pueden surgir dentro de un individuo, lo que hace que una conclusión simple sea muy difícil y, por lo tanto, es importante que los médicos intenten determinar qué pacientes tienen más probabilidades de beneficiarse de los inhibidores de PARP. Existen diferentes estrategias (combinación con quimioterapias, atacar las vulnerabilidades adquiridas asociadas con la resistencia a los inhibidores de PARP o suprimir la inestabilidad genómica) que podrían superar estos mecanismos en un intento por identificar los regímenes de tratamiento óptimos.30
Se hace imprescindible continuar estas investigaciones y agregar un grupo de control en la serie de pacientes y hacer la caracterización de las pacientes por sensibilización de las quimioterapias previas. Las terapias combinadas en el cáncer de ovario representan hoy la norma terapéutica a nivel mundial, Cuba cuenta con un arsenal terapéutico que puede entrar a beneficiar no solo a las pacientes cubanas y de otras paretes del mundo. Este estudio explora un enfoque terapéutico novedoso para el cáncer de ovario avanzado, combinado con la vacuna NGGM3/VSSP con Nimotuzumab, un anticuerpo monoclonal y quimioterapia. Esta combinación pretende potenciar la respuesta inmunitaria contra el tumor y mejorar los resultados de supervivencia. Los resultados del estudio sugieren que este enfoque combinado puede ofrecer efectivamente una ventaja de supervivencia en comparación con la inmunoterapia por si sola. Además, tanto la vacuna como el anticuerpo fueron bien tolerados en combinación con la quimioterapia, lo que indica un perfil de seguridad manejable.
Sin embargo, el estudio tiene limitaciones. Su diseño exploratorio carece de un grupo control, lo que dificulta la evaluación definitiva de la eficacia de la terapia combinada. Además, el estudio no diferencia a los pacientes en función de su sensibilidad a las terapias basadas en platino, un factor que podría influir significativamente en los resultados del tratamiento. La disponibilidad limitada de determinados fármacos quimioterapéuticos y el tamaño relativamente pequeño de la muestra (45 pacientes) restringen aún más la generalización de los resultados. Por último, el estudio no proporciona información sobre la calidad de vida de los pacientes, un aspecto importante en el tratamiento del cáncer.
A pesar de estas limitaciones, el estudio ofrece pruebas preliminares prometedoras de esta novedosa combinación terapéutica en el cáncer de ovario avanzado. Son necesarias más investigaciones, incluidos ensayos clínicos contralados de mayor tamaño, para confirmar estos hallazgos y establecer el papel de la combinación en el panorama terapéutico. También sería beneficioso investigar el impacto de la sensibilidad al platino e incorporar evaluaciones de calidad de vida en futuros estudios.
CONCLUSIONES
La evaluación clínica y de seguridad de esta investigación demostró que ambos productos fueron bien tolerados mostrando un excelente perfil de seguridad y se pueden aplicar en combinación con la QTP sin aumentar la toxicidad de la misma. La SV del grupo de pacientes a las que se le aplicó la terapia combinada AcM Nimotuzumab, vacuna NGGM3/VSSP y la QTP fue superior, necesitándose una evaluación en ensayos clínicos controlados para ratificar su eficacia terapéutica.
Contribución de los autores: Conceptualización: R.R., M.R., C.V., M.F.; Curación de datos: R.R., M.R., C.V.; Análisis formal: R.R., M.R., C.V., M.F.; Investigación: R.R., D.H., J.G., M.R., M.F.; Metodología:
R.R., M.R., C.V.; Administración del proyecto: R.R., M.R.; Recursos materiales: R.R., D.H., M.R., M.F.; Supervisión: M.R.; Validación: M.R., C.V., M.F.; Visualización: R.R., M.R.; Redacción – borrador original: Raiza R.R., M.R.; Redacción – revisión y edición: R.R., M.R., C.V., M.F.
Conflictos de intereses: Los autores no declaran tener conflictos de intereses.
REFERENCIAS
1. Globocan 2021. The Global Cancer Observatory- May, 2021.
2. Siegel R L, Miller K D, Jemal A. Cancer Statistcs, 2018. Cancer J Clin 2018; 68:7-38.
3. Anuario Estadístico de Salud MINSAP 2018, Edición 2019. Anuario_Estadistico_de_salud_ISSN: versión electrónica 1561-4433. http://bvscuba.sld.cu//Anuario_Estadistico_Cuba//2018.
4. Liu G, Yang D, Sun Y, et al. Differing clinical impact of BCRA1 and BCRA 2 mutations in serous ovarian cancer. Pharmacogenomics 2012; 13: 1525-1535.
5. Varghese A, Lele S. Rare Ovarian Tumors. In: Lele S. editor. Ovarian Cancer. Brisbane (AU): Exon Publications. Online first 29 Jul 2022.
Doi: https://doi.org/10.36255/exon-publications-ovarian-cancer-rare-ovarian-tumor
6. Cancer Biol Med. 2020, 2. Ann Oncol. 2020
7. Prat J. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet 2014; 124: 1-5. http//www.ncbi.nlm.nih.gov/pudmed/24219974.
8. Montero-Macías R , Rigolet P, Mikhael E, Krell J, Villefranque V, Lecuru F, and Fotopoulou C. Traditional Systemic Treatment Options in Advanced Low-Grade Serous Ovarian Cancer after Successful Cytoreduction: A Systematic Review and Meta-Analysis. Cancers 2022, 14, 3681. https://doi.org/10.3390/cancers14153681.
9. Bogani, G.; Maggiore, U.L.R.; Paolini, B.; Diito, A.; Martinelli, F.; Lorusso, D.; Raspagliesi, F. The detrimental effect of adopting interval debulking surgery in advanced stage low-grade serous ovarian cancer. J. Gynecol. Oncol. 2019, 30, e4. [CrossRef] [PubMed]
10. NCCN Clinical Practice Guidelines in Oncology. Ovarian Cancer including Fallopian Tube Cancer and Primary Peritoneal Cancer. Version 1. 2020. March 11, 2020.
11. Rebbeck T R, Mitran N, Wan F, et al. Association of type and location of BRCA1 and BRCA2 mutations whith risk breast and ovarian cancer. JAMA 2015; 313: 1347-1361.
12. Garcia Y G, Juan A D, Mendiola C, et al. Phase II randomized trial of neoadyuvan(NA) Chemotherapy (CT) whith or whithout Bevacizumab (Bev) in advancen ephithelial ovarian cancer (EOC) (GEICOROS/NOVA TRIAL). J Clin Oncol 2017; 35: Astrad 5508-5508.
13. du Bois A, Floquet A, Kim J W, et al. Incorporation of pazopanib in mantenance therapy of ovarian cancer. J Clin Oncol 2014; 32: 3374-3382.
14. Kaufman B, Shapira-Frommer R, Schmutzer R K, et al. Olaparib monotherapy in patients whith advanced and germline BRCA1/2 mutation. J Clin Oncol 2015; 33: 244-250.
15. Xu S, Ramos Suzarte M, Bai X, Xu B. Treatment outcome of nimotuzumab plus chemotherapy in advanced cancer patients: a single institute experience. www.impactjournals.com/oncotarget/ 2016
16. Wang XQ, Sun P, Paller AS. Ganglioside induces caveolin-1 redistribution and interaction with the epidermal growth factor receptor. J Biol Chem 2002;277(49):47028-34.
17. Roque-Navarro L, Chakrabandhu K, de Leon J, Rodriguez S, Toledo C, Carr A, de Acosta C M, Hueber A O and Perez R. Anti-ganglioside antibody-induced tumor cell death by loss of membrane integrity. Mol Cancer Ther, 7: 2033-2041, 2008
18. Informe final EC Fase I/II “Ensayo Clínico con la vacuna NGcGM3/VSSP aplicada por vía subcutánea en el tratamiento de pacientes con cáncer de mama avanzado”. Código IIC RD-EC 067.
19. Shih K K, Zhou Q C, Aghajanian C, Huh J, Soslow R A, Morgan J C, et al. Patterns of recurrence and role of adjuvant chemotherapy in stage II-IV serous ovarian borderline tumors. Gynecol Oncol. 2010;119(2):270-3. https://doi.org/10.1016/j.ygyno.2010.07.019.
20. du Bois A, Ewald-Riegler N, de Gregorio N, Reuss A, Mahner S, Fotopoulou C, et al. Borderline tumours of the ovary: A cohort study of the Arbeitsgmeinschaft Gynakologische Onkologie (AGO) Study Group. Eur J Cancer. 2013;49(8):1905-14. https://doi.org/10.1016/j.ejca.2013.01.035.
21. Cornelison, R.; Llaneza, D.C.; Landen, C.N. Emerging therapeutics to overcome chemoresistance in epithelial ovarian cancer: A mini-review. Int. J. Mol. Sci. 2017, 18, 2171. [CrossRef]
22. Lukanovic´, D.; Herzog, M.; Kobal, B.; Cˇ erne, K. The contribution of copper efflux transporters ATP7A and ATP7B to chemoresistanceand personalized medicine in ovarian cancer. Biomed. Pharm. 2020, 129, 110401. [CrossRef] [PubMed]
23. Colombo, N.; Sessa, C.; du Bois, A.; Ladermann, J.; McCluggage, W.G.; McNeish, I.; Morice, P.; Pignata, S.; Ray-Coquard, I.; Vergote, I.; et al. ESMO–ESGO Ovarian Cancer Consensus Conference Working Group, ESMO–ESGO consensus conference recommendations on ovarian cancer: Pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. Ann. Oncol. 2019, 30, 672–705. [CrossRef]
24. Zobec Logar, H.B.; Smrkolj, Š.; Merlo, S.; Bebar, S.; Kobal, B.; Škof, E.; Cerar, O.; Cvjeti´canin, B.; Vakselj, A.; Šešek, M.; et al. Smernice za Obravnavo Bolnic z Rakom Jajˇcnikov, Jajcevodov in s Primarnim Peritonealnim Seroznim Rakom, 2nd ed.; Združenje za Radioterapijo in Onkologijo SZD, Združenje za Ginekološko Onkologijo, Kolposkopijo in Cervikalno Patologijo SZD, Onkološki Inštitut: Ljubljana, Slovenia, 2016.
25. Lawrie, T.A.; Rabbie, R.; Thoma, C.; Morrison, J.; Cochrane Gynaecological, Neuro-oncology and Orphan Cancer Group. Pegylated liposomal doxorubicin for first-line treatment of epithelial ovarian cancer. Cochrane Database Syst. Rev. 2013, 10, CD010482.
26. Pignata, S.; Scambia, G.; Katsaros, D.; Gallo, C.; Pujade-Lauraine, E.; De Placido, S.; Bologna, A.; Weber, B.; Raspagliesi, F.; Panici, P.B.; et al. Carboplatin plus paclitaxel once a week versus every 3 weeks in patients with advanced ovarian cancer (MITO-7): A randomised, multicentre, open-label, phase 3 trial. Lancet Oncol. 2014, 15, 396–405. [CrossRef]
27. Falandry, C.; Rousseau, F.; Mouret-Reynier, M.A.; Tinquaut, F.; Lorusso, D.; Herrstedt, J.; Savoye, A.M.; Stefani, L.; Bourbouloux, E.; Sverdlin, R.; et al. Efficacy and safety of first-line single-agent carboplatin vs carboplatin plus paclitaxel for vulnerable older adult women with ovarian cancer: A GINECO/GCIG randomized clinical trial. JAMA Oncol. 2021, 7, 853–861. [CrossRef] [PubMed]
27. Garrido G, Tikhomirov I A, Rabasa A, Yang E, Gracia E, Iznaga N, et al. Bivalent binding by intermediate affinity of nimotuzumab: A contribution to explain antibody clinical profile. Cancer Biol Ther 2011; 11:373–82. http://dx.doi.org/10.4161/cbt.11.4.14097.
28. Bebb G, Boland W and Melosky B. Dontt jump to rash conclusions. Cancer Biol Ther 2011; 11: 639–41. http://dx.doi.org/10.4161/cbt.11.7.14920.
29. Gershenson DM, Bodurka DC, Lu KH, Nathan LC, Milojevic L, Wong KK, et al. Impact of Age and Primary Disease Site on Outcome in Women With Low-Grade Serous Carcinoma of the Ovary or Peritoneum: Results of a Large Single-Institution Registry of a Rare Tumor. J Clin Oncol. 2015;33(24):2675-82. https://doi.org/10.1200/JCO.2015.61.0873
30. Lee, E.K.; Matulonis, U.A. PARP Inhibitor resistance mechanisms and implications for post- progression combination therapies. Cancers 2020, 12, 2054. [CrossRef].
Received: July 17, 2023 / Accepted: September 30, 2024 / Published: December 15, 2024
Citation: Ruiz R, Hernández D, Viada C, García J, Fors M, Ramos M. Tratamiento de tumores de ovario en progresión con la combinación terapéutica del AcM nimotuzumab y la vacuna NGGM3/VSSP. Bionatura journal. 2024;1(4):13. doi: 10.70099/BJ/2024.01.04.13
Additional information Correspondence should be addressed to forsmarthamaria@gmail.com
Peer review information. Bionatura thanks anonymous reviewer(s) for their contribution to the peer review of this work using https://reviewerlocator.webofscience.com/
ISSN.3020-7886
All articles published by Bionatura Journal are made freely and permanently accessible online immediately upon publication, without subscription charges or registration barriers.
Publisher's Note: Bionatura Journal stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2024 by the authors. They were submitted for possible open-access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).




